
- 所有服務
- 生命科學服務平臺
- 診斷原料開發服務平臺
- 抗體藥物研發服務平臺
一種可抑制破骨細胞骨吸收的新型Nrf2激動劑
骨質疏松癥是一種以骨密度降低、骨微結構破壞、骨折風險增加為特征的代謝性骨病。破骨細胞過度活化是引起骨質疏松的重要原因之一。目前已有多種靶向破骨細胞分化和功能的藥物用于臨床,如雙膦酸鹽和地舒單抗,但這些藥物往往也存在許多不足之處,如雙膦酸鹽會引起嚴重的下頜骨壞死等并發癥,而地舒單抗則存在嚴重的停藥反彈效應。尋找新的治療靶點和開發更安全有效的治療藥物,可以為骨質疏松的規范治療提供更多的選擇。 Nrf2是一種在細胞抗氧化應答中發揮核心作用的轉錄因子。Nrf2激活后能夠啟動多種抗氧化和細胞保護基因的表達,降低ROS損傷。因此,探索安全有效的Nrf2小分子激活劑也是各種慢性氧化應激和炎癥性疾病藥物的重要研發方向。目前,Nrf2激活劑主要分為兩種,即親電性Nrf2激活劑和直接Nrf2激活劑
【1】。親電性激活劑具有副作用大, 特異性差,存在脫靶效應等不足,因而只能用于罕見病治療。目前只有兩種已被批準用于臨床,即治療復發性多發性硬化癥的富馬酸二甲酯
【2】 和治療弗里德里希共濟失調癥的omaveloxolone
【3】。而直接Nrf2激活劑尚處于實驗室研發階段,沒有一款進入臨床評估階段,且直接Nrf2激活劑的分子量常常比較大,難以透過血腦屏障用于中樞神經系統疾病的治療。

Bitopertin是一個處于臨床階段的甘氨酸攝取抑制劑,原本用于治療精神分裂癥和血液系統疾病,但其作為甘氨酸抑制劑的臨床試驗效果均不理想。本研究發現,Bitopertin可以與Keap1的Kelch結構域相互作用,減少Keap1與Nrf2的結合而激活Nrf2。Bitopertin可以抑制破骨細胞分化和骨吸收功能,并緩解由雌激素缺失引起的骨質疏松。與其他臨床上批準的Nrf2激動劑相比,Bitopertin在人類受試者中引起的不良反應發生率更低,體內安全性更高,有望作為一款新的Nrf2激活劑候選藥物使用。 目前Nrf2調控破骨細胞分化的下游直接分子機制尚不明確【4】。該研究進一步整合轉錄組學和單細胞測序等揭示了Nrf2可以轉錄激活Slc40a1/Ferroportin的表達來調控破骨細胞內鐵代謝,并通過UK Biobank前瞻性臨床數據分析和單核苷酸多態性分析等揭示了鐵代謝和骨質疏松的關聯。進一步聯合轉錄組學和代謝組學發現Nrf2和鐵可以通過調控Odc1來影響鳥氨酸代謝,進而影響破骨細胞活性和骨質疏松發生發展。
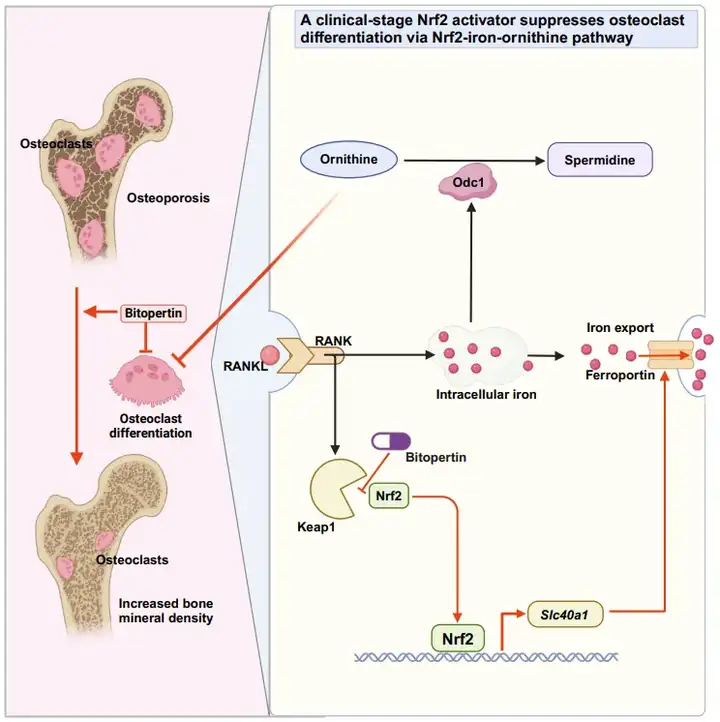
總體而言,這項研究揭示了Bitopertin作為Nrf2激動劑在各種氧化應激和炎癥性疾病中的應用潛力,揭示了Nrf2調控破骨細胞分化的深入分子機制,并提出了靶向Nrf2-iron-Odc1軸對骨質疏松的治療策略。
