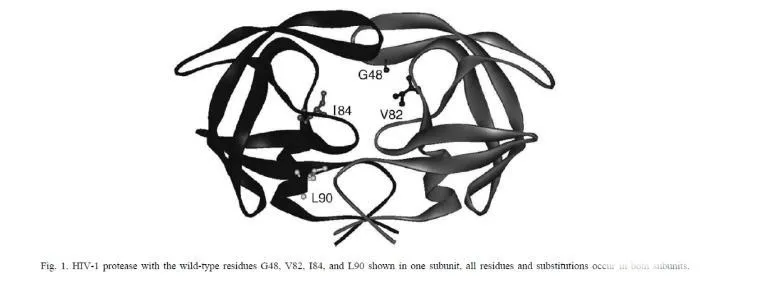
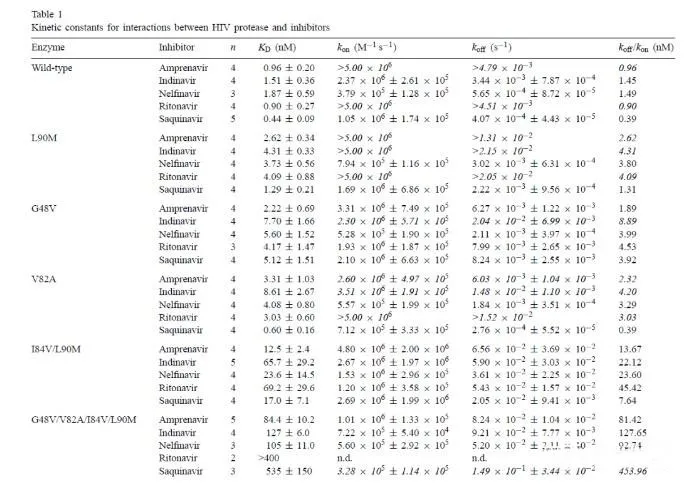
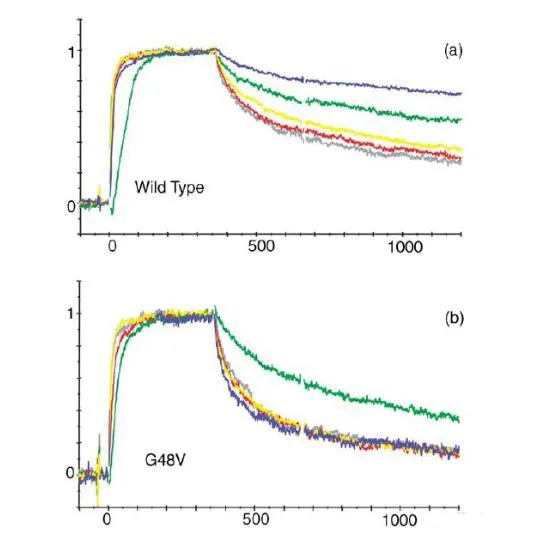
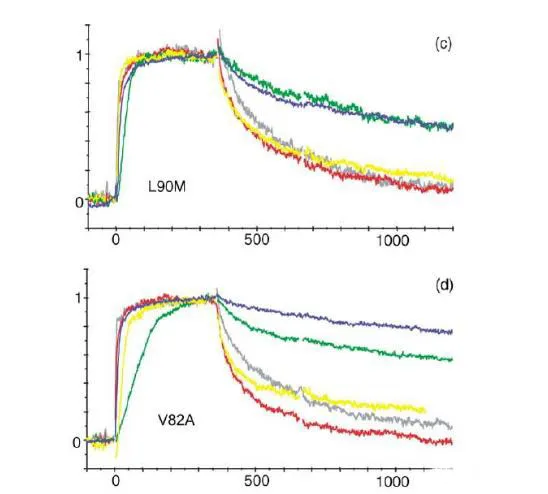
動力學在分子互作中是用來描述分析物與配體之間結合的速率(ka)和解離的速率(kd),是表征分子結合很重要的參數。在藥物研發過程中,我們可以通過檢測結合或者解離速率來判斷結合的藥物分子作用的時間和效果。這篇文獻當中作者對HIV蛋白酶突變與抑制劑耐受性的關聯性進行研究,通過BIAcore方法檢測不同突變體和抑制劑的結合的動力學和親和力,來探究影響抑制劑作用的關鍵因素。為了研究抑制劑的結構和耐藥性之間的關系,作者做了關于HIV-1蛋白酶耐藥突變體和一系列抑制劑之間的研究。突變體是根據已知的臨床常用抑制劑耐藥突變體,并結合蛋白酶中的氨基酸的位置進行設計。如下圖所示,作者構建了單個和多個位點的突變,突變的氨基酸偉G48V,V82A,I84V和L90M。接下來,作者通過Biacore檢測野生型/突變的HIV蛋白酶和抑制劑之間的親和力和動力學參數。結果如下方的表格所示。通過進一步對結合動力學進行分析,作者發現和野生型相比,突變體和抑制劑之間的解離速率明顯增加。Fig.2. 野生型/突變體和抑制劑之間結合動力學分析作者進一步對實驗結果進行了討論和分析。Leu90是一個位于二聚體表面的氨基酸殘基,替換為Met降低了二聚體的穩定性。本次實驗表明,Leu90替換為Met,對抑制劑的結合具有非特異性的作用,由于解離速率增加而親和力減弱。Gly48位于蛋白酶的flap區,對于結合位點成型和酶復合體穩定性具有重要的作用,這個位點突變之后,對saquinavir形成耐受性,解離速率增加。而82和84位點位于活性位點,突變之后引起親水性和范德華力作用的減少,數據表明結合和解離速率的改變引起親和力的減弱。
武漢研錦生物面向制藥企業、醫院和科研院所,可提供藥物釣靶質譜鑒定分析和檢測分子間親和力服務。包括藥物高通量虛擬篩選、分子對接分析、 動力學模擬、細胞原位垂釣靶點蛋白等,以及SPR、MST、DSF、BLI、ITC等親和力檢測服務和Olink 高靈敏超微量多指標蛋白芯片檢測服務。涉及小分子藥、生物藥、中藥、天然藥物等多種新藥類型,為您提供優質的藥物釣靶和活性檢測服務。